乔治·丘奇实验室再启新篇章 获拜耳投资,以非天然氨基酸与工程化大肠杆菌重塑蛋白质药物研发未来
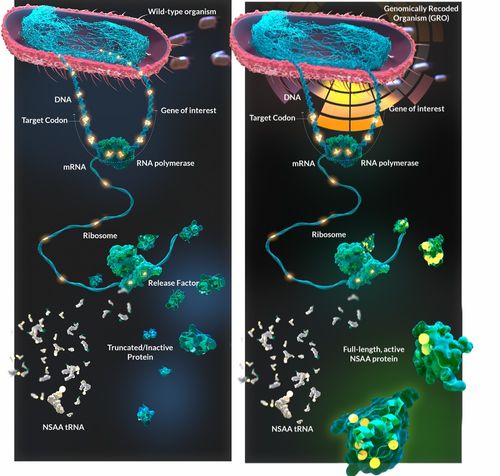
在合成生物学与生物医药的交叉前沿,传奇科学家乔治·丘奇(George Church)教授的实验室再次成为焦点。其最新孵化的公司成功获得了医药巨头拜耳(Bayer)的显著投资,旨在通过一项融合了前沿理论与工程智慧的颠覆性策略——利用非天然氨基酸优化蛋白质药物研发,并改造大肠杆菌打造更高效的“细胞工厂”,为下一代生物疗法与网络技术开发开辟全新路径。
核心突破:非天然氨基酸的精准引入
传统蛋白质药物,如抗体、酶替代疗法等,虽然疗效显著,但其功能与稳定性往往受限于自然界存在的20种标准氨基酸。乔治·丘奇实验室所推动的技术核心,在于突破这一天然限制。通过扩展生物的遗传密码,将非天然氨基酸(unnatural amino acids, UAAs)精准、特异性地整合到目标蛋白质的特定位置。这些UAAs携带着自然界不存在的化学基团,如特殊的反应活性手柄、荧光标记、或能增强稳定性的特殊结构。这使得研究人员能够:
- 赋予蛋白质全新功能:例如,为抗体药物连接上更高效、更可控的细胞毒素,实现更精准的靶向治疗,或引入可进行“点击化学”反应的基团,便于后续的定点修饰与偶联。
- 增强药物稳定性与半衰期:通过引入能形成特殊交联或具有更强疏水性的氨基酸,提高蛋白质在体内的稳定性,减少给药频率。
- 创建全新的药物作用机制:为蛋白质引入全新的催化活性或调节功能,开发出针对“不可成药”靶点的新型疗法。
工程基石:改造大肠杆菌作为高效“智能工厂”
要实现非天然氨基酸的大规模、低成本整合,必须有一个强大且可控的生产平台。研究团队将目光投向了生物学中最经典的模式微生物——大肠杆菌。通过对大肠杆菌进行深度工程化改造,他们旨在将其打造为生产这些“增强型”蛋白质药物的超级工厂:
- 重构蛋白质合成机器:改造核糖体、tRNA、氨酰-tRNA合成酶等核心组件,使其能准确识别并利用非天然氨基酸,确保翻译的保真度与效率。
- 优化代谢与供给途径:设计大肠杆菌的代谢网络,使其能高效合成或摄取非天然氨基酸前体,确保生产原料的充足供应。
- 强化生产与折叠能力:工程化细菌的分泌系统和分子伴侣网络,提高复杂蛋白质的正确折叠率和产量,满足工业化生产需求。大肠杆菌生长快速、培养成本低廉、遗传工具成熟,一旦改造成功,将能极大降低新型蛋白质药物的开发与生产成本。
战略协同:拜耳投资与网络技术开发的远景
拜耳作为全球领先的生命科学企业,此次投资不仅是对该技术平台科学潜力的认可,更是其布局下一代生物制药技术的关键一步。双方的合作有望加速将该平台应用于肿瘤学、心血管疾病、罕见病等领域的创新药物研发。
值得注意的是,该公司的愿景并未止步于药物研发。其技术中涉及的“遗传密码重编程”与“细胞工厂的精细化调控”,与网络技术开发(此处指生物分子网络、合成基因回路的设计与控制)深度关联。通过将细胞视为一个可编程的生化反应网络,利用工程学原理设计和构建基因控制回路,可以实现药物生产的动态调节、按需释放,甚至在未来开发出能感知体内疾病信号并自动生产治疗性蛋白质的“智能活体疗法”。这标志着从静态生产到动态智能系统的跨越,为治疗学带来了前所未有的可能性。
****
乔治·丘奇实验室的此次成果,是合成生物学“设计-构建-测试-学习”循环的又一次卓越体现。通过将非天然氨基酸化学、遗传密码扩展技术与微生物代谢工程、网络控制理论深度融合,他们正试图重新定义蛋白质药物的边界。在拜耳等产业巨头的加持下,这项技术有望从实验室快速走向临床应用,不仅可能催生出一系列疗效更优、机制更新的“超级药物”,更可能从根本上改变生物药物的研发和生产范式,推动医疗健康产业进入一个更加精准、高效和智能的新时代。
如若转载,请注明出处:http://www.movkeji.com/product/47.html
更新时间:2026-03-03 17:10:48